En un artículo anterior mencioné que los cromosomas pueden y tienen roles que van mucho más allá del llamado «dogma central». Al parecer, este punto no está mejor demostrado que en el fenómeno de la meiosis o la «división reductiva», que genera un gameto haploide a partir de una célula germinal diploide mediante una serie intrincada de eventos del desarrollo. De hecho, es durante las últimas etapas de la producción de un ovocito animal que muchas funcionalidades de lo que algunos menosprecian como «ADN basura» toman el centro del escenario.
Recuerde que en los huevos casi maduros, desde artrópodos hasta vertebrados, las redes meióticas son acentriolares (o acentrosomales o anastrales), porque los cromosomas que se dividirán eventualmente reclutan y secuestran tubulina. De esta forma, participan en la organización de la bipolaridad del huso requerido (Matthies et al. 1996, Theurkauf y Hawley 1992). Este último está compuesto (al menos en parte) de microtúbulos antiparalelos en la región central, que interactúan en los márgenes laterales con las masas cromosómicas en el momento de la detención de la metafase-I. Además de esto, los microtúbulos que corren de polo a polo se cruzan en el «ecuador» donde se coloca la cromatina (Jang et al. 2005). Tenemos aquí, entonces, una instancia de un citoesqueleto bipolarizado cuyos elementos de ADN (tanto «codificantes» como «no codificantes») son urdimbre y trama.
«Encima y arriba»
Pero esto es solo una parte del proceso. Los cromosomas que están a punto de sufrir meiosis (o mitosis) tienen un conjunto distinto de funciones que se agrupan y aprovechan de forma muy compleja en cinetocoros, que son las «palancas» de sus maniobras. Estos son nucleótidos «por encima y por encima» (de hecho, epi-to) durante mucho tiempo se han observado que son peculiares en sus cualidades. Por un lado, son plataformas dinámicas que tienen roles específicos de fase o etapa. En el caso de la metafase I, por ejemplo, las de un conjunto de cromátidas hermanas deben estar en cohesión (o estar emparejadas) y unidas conjuntamente a un polo, mientras que las del otro conjunto de cromátidas hermanas también deben estar en cohesión ( o estar emparejado) pero unido conjuntamente al polo opuesto (Hughes et al., 2018), como he representado aquí de una manera demasiado simplificada:
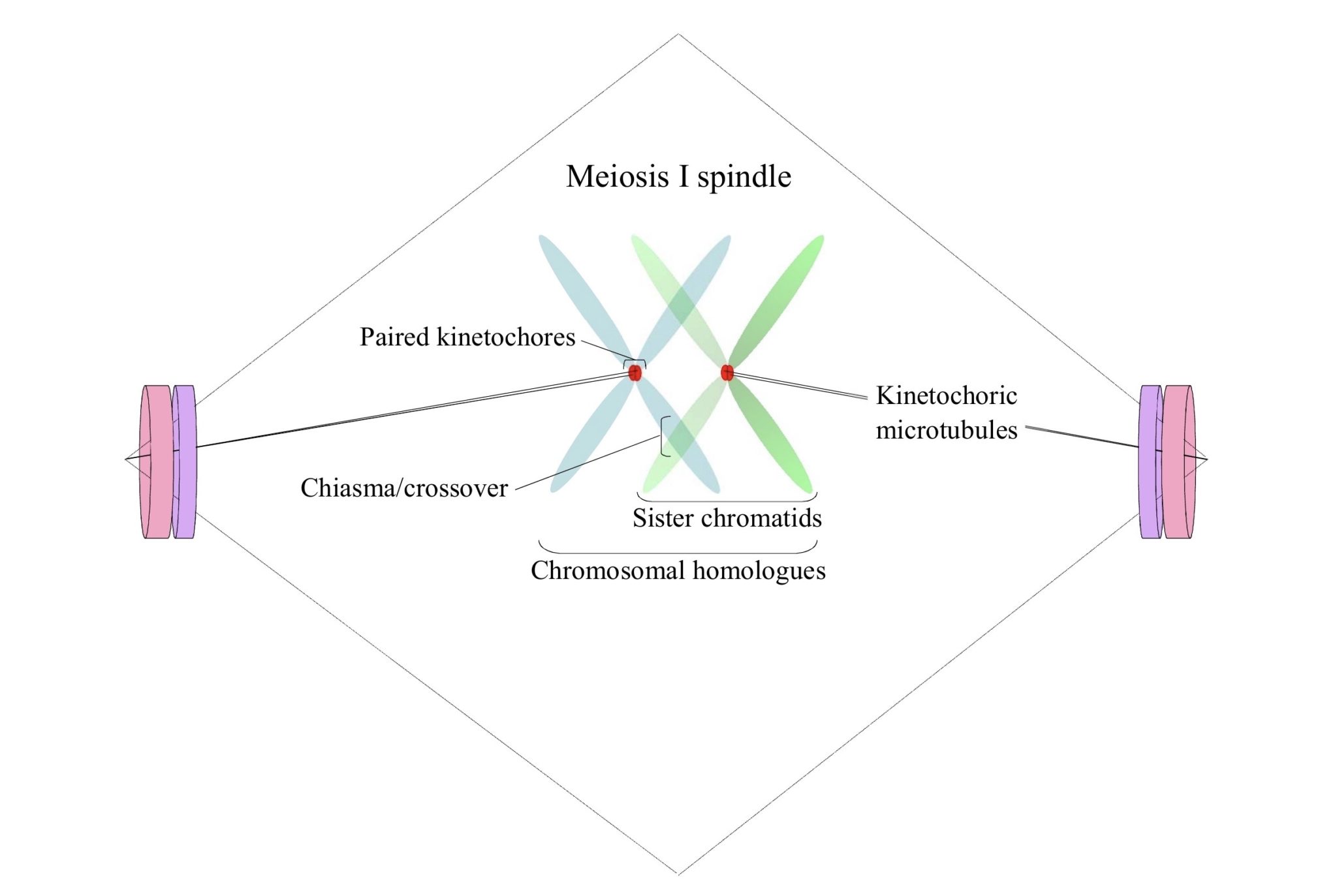
Por otro lado, como los homólogos cromosómicos están alineados en el «ecuador» del nexo meiosis I, con quiasmata que une los brazos que han sufrido cruces, tanto la cinestocórica como la simetría del huso deben ser mantenidas en general por las kinesinas y otras proteínas ( Radford et al.2017). Por otra parte, el complejo cromosómico del pasajero es necesario para la generación de este huso, y ciertos componentes del mismo, como Aurora B quinasa e Incenp, se localizan en un anillo centralizado alrededor de la cromatina / ADN (Jang et al. 2005; Radford et al. 2012). Dejando mucho de lado (ver Hughes et al., 2018), lo que debe enfatizarse es que existen regiones especializadas en cromatina, cinetocoros, que son fundamentales para la orientación y segregación adecuadas de los conjuntos cromosómicos durante la meiosis I.
Kilobases a Megabases
Ahora, el nivel más bajo de un cinetocoro se genera (y confluye con) un centrómero o locus centromérico, y lo que distingue a este último en cualquier cromosoma es su composición de histona distinta. Sin embargo, cuando se recurre a la constitución básica de los mismos en términos de los elementos de ADN que lo subyacen, todo lo que se puede encontrar es basura… kilobases a megabases de basura. Dejemos que el organismo modelo Drosophila melanogaster subraye este hecho para nosotros. Primero, todos los loci centroméricos conocidos en esta especie tienen ordenamientos de nucleótidos que son «tipográficamente» únicos. Esto no se debe a que carecen de secuencias repetitivas, sino a que les falta: cada una está compuesta de «islas complejas» de retroelementos dispersos y revueltos (especialmente los de la familia G2/Jockey-3 de elementos nucleares intercalados o LINE) que están concatenados un anfitrión de otros remanentes «basura», como los transposones de ADN (Chang et al. 2019). En segundo lugar, los mismos están flanqueados por repeticiones en tándem como (AAGAG) n, (AAGAT) n, (AATAG) n, y / u otras que tienen unidades de monómero más largas (dodeca y Prodsat). En tercer lugar, no existe un motivo específico de centrómero para todas las familias de secuencias representadas en otras partes del genoma de este taxón. Cuarto, la extensión de estos loci puede variar muchas veces. (Ver Chang et al. 2019 para estos y otros detalles). Esto agrega credibilidad a la noción de que estas regiones son «epigenómicas» en lugar de «genómicas».
Sin embargo, lo que es importante es que tengamos en cuenta dos pruebas cuando tomamos tales detalles. Por un lado, los cinetocoros / centrómeros son de suma importancia para la red de meiosis femenina I de D. Melanogaster, ya que son fundamentales para la generación de un cigoto viable. Por otro lado, sin embargo, de los cuatro homólogos cromosómicos (a saber, los del 2º, 3º, 4º y X; normalmente no hay cromosoma Y presente) que estén presentes en dicho huso, sus cinetocoros / centrómeros están en capas en estos segmentos:
- Los del segundo se llaman Capri y cada uno consta de una región de aproximadamente 1,800 pares de bases, que está enriquecida en G2 / Jockey-3 y flanqueada por las unidades (AAGAG) n y (AATAG) n.
- Los del tercero se llaman Giglio y cada uno consta de una región de aproximadamente 68,500 pares de bases, que incluye 240 copias de una variante del espaciador intergénico de ARN ribosómico junto con bloques intercalados de G2 / Jockey-3 y transposones de ADN; está flanqueado por las unidades dodeca y Prodsat.
- Los del cuarto se llaman Lampedusa y cada uno consiste en una región de aproximadamente 42,800 pares de bases, que está enriquecida en G2 / Jockey-3 y otros elementos transponibles no retrovirales; está flanqueado por las unidades (AAGAT) n.
- Finalmente, los de la X se llaman Maupiti y cada uno consiste en una región de aproximadamente 70,000 pares de bases, con largos tramos de G2 / Jockey-3 más otras repeticiones complejas y divergentes; está flanqueado por un tramo corto de unidades (AAGAT) n en uno de sus lados, pero en general está rodeado por las unidades (AAGAG) n.
Un proceso causal de arriba hacia abajo
Lo que sugieren estas dos pruebas, entonces, es que lo que puede ser «basura» en un nivel puede ser de suma importancia en otro nivel. Esto sucede, creo, a través de un proceso causal de arriba hacia abajo al que Paul Davies (2012) ha aludido, explicable en parte por el aumento de
Los términos normales que se refieren a las fuerzas locales contenidas en el Hamiltoniano para la cromatina con términos no locales adicionales (presumiblemente pequeños) que representan información funcional (es decir, semántica o contextual). Al acoplar la dinámica mecánica e informativa de esta manera, las leyes dinámicas que describen el comportamiento de la cromatina dependerían del tiempo y cambiarían de acuerdo con el estado informativo del sistema. La información tendría una tracción directa, aunque sutil, sobre la materia y permitiría ejercer el control epigenético directamente sobre la cromatina misma.
Esto implicaría un «acoplamiento explícito entre las leyes dinámicas y los estados ricos en información, dotando a las entidades de nivel superior, como la información contextual, con una eficacia causal directa sobre la materia junto con las fuerzas intermoleculares».
Si consideramos que esta «información contextual» es residente en todos los niveles de la red de meiosis I, desde el huso en su conjunto hasta (digamos) todos y cada uno de los lugares centroméricos, entonces el ADN del satélite y el retroelemento «con eficacia causal directa» pueden estar dotados de estados portadores de información. Por supuesto, «tal propuesta representa una ruptura decisiva con la formulación normal de la teoría de los sistemas dinámicos», como señala Davies, lo que significa que «las teorías de este tipo permanecen en gran parte inexploradas». Pero explorarlas deberíamos… y especialmente donde la citología se encuentra con el ADN «basura».
Literatura
Chang C.-H., Chavan A., Palladino J., et alia. 2019. Islands of retroelements are major components of Drosophila centromeres. PLoS Biology 17: e3000241.
Davies P.C.W. 2012. The epigenome and top-down causation. Interface Focus 2: 42-48.
Hughes S.E., Miller D.E., Miller A.L., Hawley R.S. 2018. Female meiosis: synapsis, recombination, and segregation in Drosophila melanogaster. Genetics 208: 875-908.
Jang, J.K., Rahman T., McKim, K.S. 2005. The kinesinlike protein Subito contributes to central spindle assembly and organization of the meiotic spindle in Drosophila oocytes. Molecular Biology of the Cell 16: 4684-4694.
Matthies H.J., McDonald H.B., Goldstein L.S., Theurkauf W.E. 1996. Anastral meiotic spindle morphogenesis: role of the nonclaret disjunctional kinesin-like protein. Journal of Cell Biology 134: 455-464.
Radford S.J., Jang J.K., McKim K.S. 2012. The chromosomal passenger complex is required for meiotic acentrosomal spindle assembly and chromosome biorientation. Genetics 192: 417-429.
Radford S.J., Go A.M., McKim K.S. 2017. Cooperation between kinesin motors promotes spindle symmetry and chromosome organization in oocytes. Genetics 205: 517-527.
Theurkauf W. E., Hawley R.S. 1992 Meiotic spindle assembly in Drosophila females: behavior of nonexchange chromosomes and the effects of mutations in the nod kinesin-like protein. Journal of Cell Biology 116: 1167-1180.
Artículo originalmente publicado en inglés por Richard Sternberg Ph.D.