Una de las doctrinas más esenciales de la evolución darwiniana, además del descenso común universal con modificación, es la noción de que las similitudes complejas indican homología y están ordenadas en un patrón anidado congruente que facilita la clasificación jerárquica de la vida. Cuando este patrón se ve interrumpido por evidencia incongruente, dicha evidencia conflictiva se explica fácilmente como homoplasias con explicaciones ad hoc, como apomorfías subyacentes (paralelismos), reducciones secundarias, convergencias evolutivas, atracción de ramificación larga y clasificación incompleta de linajes.
Cuando estudiaba en la década de 1980 en la Universidad de Tubinga, donde el fundador de la sistemática filogenética, el profesor Willi Hennig, enseñaba una primera generación de cladistas, todavía todos pensamos que tales homoplasias son las excepciones a la regla, por lo general restringidas a simples o poco conocidos personajes. Desde entonces, la situación ha cambiado profundamente. La homoplasia ahora se reconoce como un fenómeno omnipresente (por ejemplo, los ojos evolucionaron 45 veces de forma independiente y la bioluminiscencia 27 veces; cientos de ejemplos más se pueden encontrar en el sitio web «Mapa de la vida» de la Universidad de Cambridge).
La solución de la vida
Este estado de cosas obligó a George McGhee, profesor de paleobiología de la Universidad de Rutgers, a escribir un libro, Convergent Evolution: Limited Forms Most Beautiful (2011) (Evolución convergente: Formas limitadas más bellas (2011)). Él sugiere que la convergencia es tan común porque las formas viables son muy limitadas. Sin embargo, no explica cómo la evolución logra encontrar estas soluciones limitadas una y otra vez a través de un proceso de búsqueda aleatorio. Después de todo, la selección solo explica la supervivencia del más apto, pero no la llegada del más apto.
Asimismo, el paleontólogo Simon Conway Morris escribió dos libros, Life’s Solution (2003) y The Runes of Evolution (2015), en los que concluyó que el increíble número de convergencias se debió a que la evolución no es el proceso contingente postulado por Stephen Jay Gould ( 1989) en su libro La vida maravillosa. Gould pensó que si de alguna manera pudiéramos rebobinar la cinta de la evolución, todo se desarrollaría de manera muy diferente. Según Conway Morris, las mismas novedades ocurren tan a menudo en grupos no relacionados que esto sugiere que estas novedades no son producto de la mera contingencia sino que están tan limitadas por factores externos que rebobinar la cinta de la evolución conduciría a resultados muy similares (ver también Conway Morris 2009).
Por supuesto, los darwinistas no se sienten cómodos con las implicaciones más profundas de un proceso de evolución no contingente (Ruse 2004, Coyne 2012, 2015), que huele a estar diseñado para un propósito. Aparte de eso, la mayoría de los biólogos ni siquiera leen entre líneas que esto es básicamente una rendición de un paradigma fundamental del darwinismo, que afirmaba que las novedades biológicas similares sugieren una relación filogenética (ancestro común).
El problema empeora cuanto más aprendemos sobre el registro fósil, la distribución de caracteres entre organismos recientes y los fundamentos genéticos y de desarrollo de muchos personajes. Algunos taxónomos esperaban que la genómica podría salvar la biosistemática del mal de la homoplasia, ya que la gran cantidad de datos inundaría el ruido «menor» de homoplasias. Pero esto resultó ser un sueño imposible, como documentan las numerosas filogenias moleculares conflictivas. Incluso aquellos caracteres genéticos que se creía que eran imposibles de sufrir de convergencia, como elementos transponibles, resultaron ser incongruentes (por ejemplo, en el caso del gorila, el chimpancé y la tricotomía humana), lo que requería un epiciclo totalmente nuevo ad hoc de explicación en términos de clasificación de linaje incompleta.
El tercer ojo
El tercer ojo de los vertebrados proporciona una ilustración perfecta de este punto, encabezado por un descubrimiento reciente muy sorprendente que se analiza a continuación. Qué, ¿un tercer ojo? No estoy hablando del espiritualismo de la Nueva Era ni del cíclope de la antigua mitología griega, sino de un órgano sensorial de la luz poco conocido.
Ojos dorsales mediana disparejos, junto con un par lateral de ojos más eficientes, se conocen de crustáceos (ojo nauplio), artrópodos (por ejemplo, 3 ocelos en insectos), y vertebrados (tercer ojo, ojo pineal, o de los ojos parietal en la parte la parte superior del cráneo). Este último es siempre más pequeño que los ojos de lentes laterales emparejados, y en las especies vivas muy discreto. Los evolucionistas creen que este órgano es posiblemente homólogo al punto sensible a la luz en la parte superior de la cabeza de las larvas, y el ojo mediano de las larvas de tunicado, porque los estudios filogenéticos sugieren que los tunicados son los parientes más cercanos de los vertebrados, que a veces se supone que se originaron de una especie de larva de tunicado neoténico.
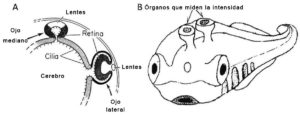
Todos los ojos de vertebrados pares emparejados así como pares medios no emparejados, se desarrollan a partir de una evaginación del cerebro (diencéfalo). La parte posterior del diencéfalo (epitelio) desarrolla una evaginación dorsal inicialmente única (complejo pineal), que luego se divide en dos órganos aproximadamente simétricos bilaterales que rotan su ubicación para convertirse en un órgano pineal caudal (glándula pineal) y un órgano parapineal rostral (Kolb et al. 1998). Estos a menudo retienen una ligera asimetría con el órgano pineal que se origina más a la derecha y el órgano parapléjico más a la izquierda de la línea media del cerebro.
Esto corresponde al hecho de que las lampreas modernas poseen dos ojos medianos que están orientados uno encima del otro o uno detrás del otro, mientras que algunos peces Devonianos (por ejemplo, arthrodira, estegosalacos y peces muy tempranos) tenían dos agujeros pineales / parietales en el cráneo uno al lado del otro (Eakin 1973: 16-17). En los vertebrados modernos con mandíbula acuática («peces» en el lenguaje cotidiano), el tercer ojo, si está desarrollado, está formado por el órgano pineal, mientras que el órgano parapléjico está más o menos reducido.
En los tetrápodos, el órgano pineal caudal se atrofia como una glándula pineal fotorreceptora (epífisis), mientras que el órgano parapineal rostral forma el tercer ojo llamado ojo parietal. Entre los vertebrados recientes, el ojo parietal está ausente en salamandras, tortugas, cocodrilos, aves y mamíferos, pero muy desarrollado en lepidosaurios (tuataras juveniles y muchos lagartos) con lente, córnea y retina evertida, siendo este último más similar a la de un pulpo en lugar de a la retina invertida de los ojos de la lente lateral.

Crédito de la foto: TheAlphaWolf [CC BY-SA 3.0 o GFDL], de Wikimedia Commons.
En las ranas y sapos juveniles, un tercer ojo similar pero menos sofisticado se desarrolla como una vesícula terminal del órgano parapléjico.

Crédito de la foto: TheAlphaWolf [CC BY-SA 3.0 o GFDL], de Wikimedia Commons.
Estos terceros ojos en vertebrados no permiten una visión similar a una imagen, sino que solo diferencian la luz de la oscuridad. Pueden ayudar a detectar las sombras de los depredadores que atacan desde arriba, como lo sugiere el comportamiento de algunos lagartos. Más importante aún, son cruciales para los ritmos circadianos y estacionales. Ésta también es la función de la glándula pineal en los humanos, que produce la hormona del sueño melatonina. Muchas otras especies de vertebrados tienen un órgano pineal intracraneal como un fotorreceptor de cerebro profundo. En los vertebrados fósiles, la posesión de un tercer ojo extracraneal se puede deducir de la presencia de un foramen parietal entre los huesos parietales del cráneo.

Crédito de la foto: Archaeodontosaurus [GFDL, GFDL, CC-BY-SA-3.0 o CC BY-SA 3.0], a través de Wikimedia Commons.
Por lo tanto, tenemos un conocimiento bastante bueno sobre la distribución de los terceros ojos en los vertebrados fósiles y modernos. Aquí hay una lista de los que tienen y no tienen:
- lampreas, pero no los hagfish ciegos
- Peces agnathan paleozoicos como ostracodermos y placodermos
- tiburones pelágicos
- algunos peces con aletas radiadas (por ejemplo, actinopterigios del tallo paleozoico, peces espátula, bagre, atún e incluso el pez cueva ciego Astyanax mexicanus)
- «crossopterygians» fósiles, pero no el celacanto moderno
- pulmonfish fósiles tempranos, pero no todos los modernos
- Tetrapodos de tallo con aletas lobuladas y «stegocephalian» (por ejemplo, Eusthenopteron, Elpistostege, Panderichthys, Tiktaalik, Acanthostega, Seymouria)
- tallo anfibios (Temnospondyli) y ranas juveniles modernas y sapos (Anura), pero no salamandras (Urodela) y cecilias (Gymnophiona)
- reptiles de tallo (por ejemplo, Paleothyris)
- Parareptilia (Anapsida como Captorhinus)
- Lepidosauria (bien visible en tuatara juveniles, mosasaurios, lagartos monitores, iguanas, lagartos verdaderos), pero no serpientes, geckos y camaleones
- Ictioptergia (ictiosaurios)
- Sauropterygia (placodontians, nothosaurs, plesiosaurs)
- la tortuga madre más antigua y más primitiva, Eunotosaurus, pero ninguna tortuga posterior (incluyendo Pappochelys)
- arqueosauromorfos tempranos como Prolacerta, proterosúquidos y posiblemente Triopticus primus, pero no más archosauriformes avanzados (incluidos Euparkeria, Phytosauria, cocodrilos, pterosaurios, dinosaurios y aves)
- Mamíferos del Pérmico («pelicosaurios», «terápsidos», «Cynognathia»), pero no mamíferos (incluidas las formas mamíferas primitivas del Triásico como Morganucodon)
¿Adivina qué deben asumir los evolucionistas? Con base en la distribución de los ojos pineal y parapineal recién mencionada y el foramen parietal: los vertebrados agnathan primitivos tenían dos ojos medianos formados por el órgano pineal y parapineal. Estos fueron retenidos al menos hasta los antepasados tempranos del pez pulmonado (documentados por el foramen parietal apareado), pero el ojo parapléjico se redujo independientemente en Chondrichthyes (tiburones y rayas), peces con aletas radiadas, celacantos y peces pulmonados modernos. En la mayoría de los peces óseos modernos (incluidos los peces con aletas radiadas, los celacantos y algunos peces pulmonados modernos) el ojo pineal se redujo varias veces de forma independiente. En el linaje de tetrápodos, el ojo pineal también se redujo, y solo el ojo parapineal se mantuvo como el ojo parietal. Este ojo parietal se redujo luego de forma independiente en anfibios no anuros, algunos lagartos, serpientes, tortugas, arcosaurios (cocodrilos, pterosaurios, dinosaurios, aves) y en mamíferos.
En consecuencia, solo las ranas y sapos juveniles, así como los tuataras juveniles y muchas lagartijas, conservaron un ojo parietal parapinoideo entre los vertebrados terrestres vivos. Qué paseo tan salvaje. Y a lo largo del camino, la varita mágica de la selección natural supuestamente explica por qué el mismo órgano aparece y desaparece y reaparece, porque gana valor de adaptación y lo pierde, y lo vuelve a ganar. ¿No convencido? Yo tampoco. Pero la mayor sorpresa está por llegar.
Abróchense los cinturones de seguridad, por favor
Claramente, la presencia o ausencia de un tercer ojo en vertebrados muestra un patrón extremadamente incongruente. Los evolucionistas necesitan explicar esta incongruencia. Dado que la mayoría de los grupos de vertebrados paleozoicos tenían un tercer ojo parietal, los evolucionistas tienen que suponer que muchos grupos diferentes de vertebrados «decidieron» independientemente después de la extinción masiva permio-triásica que podrían simplemente prescindir de esta innovación previamente tan útil y adaptativa. Por lo tanto, los evolucionistas necesitan no solo la suposición ad hoc de múltiples reducciones secundarias independientes, sino también una explicación causal para este extraño fenómeno.
Las explicaciones sugeridas incluyen una reducción de la visión del color correlacionada con el hábitat de agua dulce, o el estilo de vida nocturno, o una transición a la endotermia (Gerkema et al., 2013, Benoit et al., 2016, Emerling 2017a). La nocturalidad como explicación estaría de hecho de acuerdo con el hecho de que el tercer ojo está ausente en los geckos nocturnos y en las serpientes, que se cree que se originaron de un antepasado madriguera nocturna, y que solo es prominente en tuataras juveniles, que tienen un diurno estilo de vida, mientras que se elimina en los adultos, que tienen un estilo de vida nocturno. Sin embargo, que dos explicaciones causales diferentes (cuello de botella nocturno versus transición a endotermia) han sido sugeridas para la reducción de los ojos parietales en mamíferos, muestra que en realidad estamos tratando con explicaciones ad hoc artificiales. Cualesquiera que sean los datos, una narrativa elegante podría ser falsificada fácilmente para explicar esta evidencia.
Emerling (2017a) demostró que las proteínas fotosensibles opsin parietopsin y parapinopsin, que se encuentran en el tercer ojo de lampreas y lagartijas, solo están presentes como pseudogenes no funcionales en tortugas, cocodrilos y aves, que carecen de un tercer ojo (Caspermeyer 2017). Para ser justos, los restos de genes rotos (pseudogenes), si realmente estuvieran desprovistos de función (muchos defensores del DI predecirían que esto es falso), de hecho pueden apoyar la noción de ascendencia común y una reducción secundaria del tercer ojo en estos grupos. Esto fue fácilmente enfatizado por Emerling (2017b), quien claramente parece tener un hacha evolutiva para moler, en su blog personal Evolution for Skeptics.
Sin embargo, admitió en su artículo técnico que estos pseudogenes en tortugas, cocodrilos y aves en realidad no comparten mutaciones inactivantes, por lo que la inactivación no se puede atribuir fácilmente a un ancestro archaelosaurian común. Esto es al menos extraño para los cocodrilos y las aves, porque incluso sus supuestos ancestros archosauriformes ya compartían la ausencia de un ojo parietal, por lo que se esperaba que la inactivación fuera homóloga. Aparte de este tema, simplemente apelar a la ascendencia común y la reducción secundaria múltiple, por supuesto, no hace nada para explicar lo que realmente está pasando.
Emerling es consciente de esto y, por lo tanto, sugirió un cuello de botella nocturno en los crocodilianos como explicación causal de la pérdida del ojo parietal. Sin embargo, no hay evidencia de tal cuello de botella en la línea del tallo del arquosaurio, y esto es fatal para su argumento porque no son solo cocodrilos sino todos los arcosaurios que carecen de ojo parietal y sus opsinas, por lo que un cuello de botella nocturno en cocodrilos sería totalmente irrelevante y demasiado tarde para explicar algo. Esto también muestra que la endotermia compartida de aves y mamíferos no es una buena explicación para su falta compartida del ojo parietal y sus opsinas, ya que se cree que las aves se originaron en arcosauros que ya carecían de ojo parietal pero que no eran endotérmicas en absoluto. La mayoría de las explicaciones ad hoc que pueden parecer plausibles a primera vista se vuelven bastante dudosas en un examen más detallado.
Un problema mucho más grande
De todos modos, un problema mucho más grande para el darwinismo surge de ganancias independientes (homoplásticas) de caracteres complejos, en lugar de pérdidas independientes, especialmente cuando se implican escenarios evolutivos altamente inverosímiles. Aquí hay un ejemplo reciente de esto que también involucra los ojos medianos de los vertebrados.
Basado en dos fósiles fragmentarios, Smith et al. (2018) acaba de describir el nuevo monitor lagarto que Saniwa considera de la Formación Bridger de 49 millones de años en Wyoming. ¡Ambos especímenes conocidos sorprendentemente tenían cuatro ojos! Adicional al par normal de lentes laterales, y al tercer ojo parietal usual de los lagartos, esta nueva especie en realidad tenía un cuarto ojo pineal como una lamprea. Ningún otro vertebrado con mandíbulas tiene algo remotamente parecido a este, a pesar de que este lagarto fósil es el pariente más cercano a los saurópsidos del género moderno Varanus y por lo tanto anidado profundamente dentro de los vertebrados terrestres modernos.
¿Qué? Esto suena casi demasiado extraño para ser verdad. Sin embargo, dado que el artículo fue publicado el 2 de abril de 2018, en la prestigiosa revista Current Biology definitivamente no es una broma del mes de abril. Los autores muerden la bala y proponen audazmente que el lagarto varanus extinto re-evolucionó un cuarto ojo desde el órgano pineal, similar al supuesto estado ancestral en las lampreas. Esto significa que aunque un ojo pineal se perdió al menos desde el origen de los tetrápodos hace unos 390 millones de años, 340 millones de años más tarde apareció otra especie común de lagartos varanus y dijo: «Oye, ¿qué tal si tenmos cuatro ojos otra vez?» Luego re-desarrolló este órgano que obviamente no tenía suficiente valor adaptativo para ningún otro tetrápodo en la historia de la vida para permitir que el poder creativo ilimitado de la evolución hiciera su magia. Sin embargo, este notable esfuerzo no salvó a esta especie de la extinción sin ningún descendiente superviviente, mientras que numerosos lagartos monitores sin ojo fueron más afortunados.

Crédito de la foto: Arturo de Frias Marques [CC BY-SA 4.0], de Wikimedia Commons.
En su reseña del sorprendente descubrimiento, Witmer (2018) señala:
¿Cómo podría un ojo pineal simplemente volver a evolucionar?… Pero ¿por qué Saniwa? ¿Qué tiene de especial este lagarto? Nada es especial, por lo que podemos decir. Smith y sus colegas ofrecen algunas sugerencias, pero es justo decir que el beneficio funcional de tener ambos ojos parapinoso y pineal sigue siendo oscuro. Este hallazgo también significa que, de repente, ya no estamos seguros de qué ojo órgano – pineal o parapineal – estaba asomándose a través del foramen parietal de una gran cantidad de antiguos tetrápodos extintos.
Finalmente, hay una última frase final mencionada por Witmer (2018):
En 1893, el paleontólogo belga Louis Dollo formuló la Ley de irreversibilidad de la evolución, que simplemente establece: lo que se pierde no se recuperará. Algunas leyes están destinadas a romperse, y la re-evolución de un ojo pineal en Saniwa no es el primer atavismo que se informa. Aún así, no es una ocurrencia común, y es tan raro en este caso que plantea nuevas preguntas.
Obviamente, las «leyes» evolutivas son bastante maleables y deben ceder cuando se vuelvan demasiado engorrosas. La evidencia conflictiva no importa, las leyes rotas no importan. Lo que realmente importa es preservar la gran narrativa de la escoria del estanque para nosotros.
Podemos concluir con seguridad: es un mito épico, voluntariamente perpetuado por los biólogos evolutivos, que las similitudes entre los organismos en su mayoría caen en un patrón jerárquico de grupos anidados y, por lo tanto, sugieren una ascendencia común e indican una relación filogenética. En realidad, esta afirmación se contradice con una avalancha de incongruencias y patrones reticulares que arrojan dudas sobre los paradigmas fundamentales de la biología evolutiva, como las nociones de homología y descendencia común. Esta incómoda evidencia conflictiva se explica con una pila de hipótesis ad hoc, correlacionadas con escenarios evolutivos cada vez más artificiales e inverosímiles.
Literatura:
- Benoit J, Abdala F, Manger PR, Rubidge BS 2016. El sexto sentido en los precursores de mamíferos: variabilidad del foramen parietal y la evolución del ojo pineal en los terápsidos de eutheriodonte sudamericano permio-triásico. Acta Palaeontologica Polonica 61 (4): 777-789.
- Caspermeyer J 2017. Cómo las tortugas y los cocodrilos perdieron el ojo «tercero» parietal y sus diferentes adaptaciones de visión en color. Biología Molecular y Evolución 34 (3), 776-777.
- Conway Morris S 2003. La solución de la vida: seres humanos inevitables en un universo solitario. Cambridge Univ. Prensa, 464 pp.
- Conway Morris S 2009. Evolución: como cualquier otra ciencia, es predecible. Transacciones filosóficas de la Royal Society B 365, 133-145.
- Conway Morris S 2015. Las runas de la evolución. Templeton Press, 528 pp.
- Coyne J 2012. Paleobiologist Simon Conway Morris da evidencia de Dios de la evolución. Por qué la evolución es verdad 10 de septiembre de 2012.
- Coyne J 2015. El nuevo libro de Simon Conway Morris afirma una vez más que la evolución de las criaturas humanas era inevitable. Él está equivocado. Why evolution is true! el 3 de mayo de 2015.
- Eakin RM 1973. El tercer ojo. Prensa de la Universidad de California, 157 pp.
- Emerling CA 2017a. Visión del color Archelosaurian, pérdida de ojo parietal, y el cuello de botella nocturno crocodylian. Molecular Biology and Evolution 34 (3), 666-676.
- Emerling CA 2017b. Las tortugas, las aves y los crocodilianos tienen restos genéticos de un «tercer ojo». Evolution for Skeptics June 16, 2017 16 de junio de 2017.
- Gerkema MP, Davies WIL, Foster RH, Menaker M, Hut RA 2013. El cuello de botella nocturno y la evolución de los patrones de actividad en los mamíferos. Proceedings of the Royal Society B 280: 20130508.
- Gould SJ 1989. Wonderful Life. The Burgess Shale and the nature of history. W.W. Norton Co.
- Kolb H, Fernández E, Nelson R (eds) 1995. Webvision – La organización de la retina y el sistema visual. Centro de Ciencias de la Salud de la Universidad de Utah, Internet book.
- McGhee GR 2011. Evolución convergente: formas limitadas más bellas. MIT Press, 336 pp.
- Ruse M 2004. Book Review 2: La solución de la vida: seres humanos inevitables en un universo solitario. Palaeontologia Electronica 2: 3.
- Smith KT, Bhullar BAS, Köhler G, Habersetzer J 2018. El único vertebrado con mandíbulas conocido con cuatro ojos y el Bauplan del complejo Pineal. Current Biology 28, 1101-1107.
- Universidad de Cambridge. Map of Life — Convergent Evolution Online.
Witmer LM 2018. Paleoneurología: una vista para cuatro ojos. Biología actual 28: R311-R313. - Foto superior: iguana azul, Parque Zoológico Nacional, Washington, D.C., por Jarek Tuszyński / CC-BY-SA-3.0 y GDFL [CC BY-SA 3.0 o GFDL], de Wikimedia Commons.





