Imagine un día en que los autos sin conductor hagan que no sea necesario conducir más. Ahora, imagina un día en el futuro lejano en el que ni siquiera tienes que subirte al auto. En cambio, cuando sales por la puerta principal, un automóvil se reúne a tu alrededor, se levanta del suelo, te lleva flotando a tu destino y luego se desmonta en anticipación de recoger al próximo pasajero. Algo como esto realmente sucede en las células vivas. Según las noticias del Laboratorio Europeo de Biología Molecular (EMBL):
Los investigadores de EMBL Heidelberg han producido imágenes detalladas de las intrincadas capas proteicas que rodean las vesículas de tráfico, las «cápsulas de transporte» que mueven el material dentro de las células biológicas. El estudio, publicado hoy en Science, proporciona una nueva comprensión de las máquinas complejas que conforman la red logística de las células.
Las vesículas son responsables de transportar moléculas entre los diferentes compartimientos dentro de una célula y también de llevar material a las células desde el exterior. Existen varios tipos de vesículas: cada una tiene un tipo específico de recubrimiento que está formado por diferentes proteínas y se ensambla en una membrana que rodea la vesícula. [Énfasis añadido.]
Existen tres modelos de “cápsulas de transporte” que los biólogos moleculares conocen, cada uno con sus propias proteínas específicas de la cubierta: Coat Protein 1 (COPI), Coat Protein 2 (COPII) y vesículas recubiertas de clatrina (CCV). Cada capa tiene sus propias proteínas, adaptadores y funciones. El primer artículo en Science analiza en detalle el COPI; pero primero, mencionemos COPII. Este tipo de vesícula lleva proteínas del retículo endoplásmico (ER), donde se ensamblaron, al aparato de Golgi, donde se empacarán para su entrega. Esto se llama transporte anterógrado (hacia adelante).
COPI es lo contrario; Lleva las proteínas del Golgi a la sala de emergencias, o a diferentes compartimentos del Golgi. Esto se llama transporte retrógrado (hacia atrás). Sorprendentemente, las proteínas de la cubierta en estas vesículas son muy diferentes. Las capas COPII están hechas de cuatro proteínas que se ensamblan con una simetría cuádruple de manera secuencial, usando proteínas adaptadoras separadas. COPI es más complicado. Tiene siete proteínas discretas que se unen simultáneamente, formando complejos con simetría triangular que incluyen la función del adaptador (es decir, permitiendo que el complejo se una a la membrana de la vesícula).
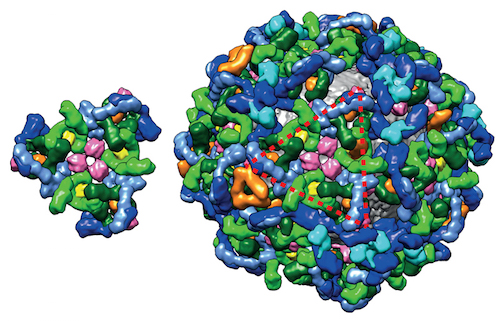
Los investigadores de EMBL empujaron la envoltura de la microscopía de crioelectrones para determinar la naturaleza de las «tríadas» llamadas coatómeros que conforman la capa. Descubrieron que las siete proteínas forman dos complejos que se superponen en una capa de 14 nanómetros (nm) de espesor, una fracción sustancial de la vesícula típica de 100 nm de diámetro. Un artículo de Perspectiva en el mismo número de la revista Science dice que todavía hay mucho que aprender sobre estos recubrimientos: «queda por determinar qué roles específicos juegan estas conformaciones en las funciones de los recubrimientos respectivos», escriben Noble y Stagg. Lo que se sabe es que las tríadas de coatómeros hacen contacto con hasta cuatro tríadas vecinas. Esto les da una flexibilidad estructural que es distinta de los otros tipos de vesículas recubiertas. Los autores del artículo especulan sobre las razones de esto:
En los modelos existentes para las capas de vesículas de clatrina y COPII, múltiples subunidades idénticas hacen el mismo conjunto de interacciones con el mismo número de vecinos. La flexibilidad estructural permite la formación de vesículas a partir de diferentes números totales de subunidades. En base a estos principios, se han propuesto modelos similares a clatrina y COPII para la capa de COPI ensamblada. En cambio, encontramos que el coatómero ensamblado puede adoptar diferentes conformaciones para interactuar con diferentes números de vecinos. Al regular las frecuencias relativas de diferentes patrones de tríadas en el revestimiento de COPI durante el ensamblaje, por ejemplo, al estabilizar conformaciones particulares de revestimientos, la célula tendría un mecanismo para adaptar el tamaño y la forma de las vesículas a cargas de diferentes tamaños.
El documento incluye modelos de color y dos animaciones de movimiento de cómo las proteínas se unen, protegiendo la carga mientras viaja a su destino de orgánulo a orgánulo.
Recubrimientos de clatrina
Una capa proteica mejor entendida está hecha de clatrina. El nombre proviene de una palabra latina para enrejado. Las moléculas individuales de clatrina, formadas por 3 cadenas pesadas y 3 cadenas ligeras, se parecen a un molinete de tres radios llamado triskelion. Encajan perfectamente alrededor de la vesícula en una estructura en forma de jaula que se asemeja a una cúpula geodésica. Una hermosa animación de la Facultad de Medicina de Harvard muestra cómo muchas otras proteínas trabajan con la clatrina para formar la capa de vesículas y desarmarla después de su uso, para que la triskelia pueda reciclarse. Las vesículas pueden importar y exportar moléculas al exterior de la célula o transportarlas dentro del citoplasma. Las proteínas clatrina también están implicadas en la división celular, donde ayudan a organizar los cromosomas en el huso.
La animación necesitará una actualización, porque se informó algo nuevo sobre las vesículas recubiertas de clatrina (CCV) y los hoyos (CCP) que se forman cuando la membrana invagina para traer carga desde el exterior. Otro equipo de EMBL, que también informa en la revista Science, descubrió que la clatrina es más gimnástica de lo que se reconocía anteriormente.
A diferencia de lo que se muestra en la animación, la red de clatrina se forma plana en la superficie de la membrana interna antes de que comience la invaginación. Luego, a medida que la membrana se pliega hacia adentro, la red se estira y se reconfigura a sí misma, manteniendo la misma área de superficie pero siguiendo la forma de la vesícula a medida que se alarga. Con su carga segura dentro, la vesícula se pellizca y forma una esfera. El comunicado de prensa de EMBL expresa la sorpresa ante los cambios de forma:
John Briggs, científico senior de EMBL Heidelberg, dijo: «Nuestros resultados fueron sorprendentes, porque las proteínas tienen que sufrir algunas transformaciones geométricas complicadas para pasar de una forma plana a una curva, por eso los científicos favorecieron el segundo modelo para tal largo tiempo.»
(El «segundo modelo», ahora falsado, se refiere a la idea de que «la clatrina se ensambla directamente, asumiendo la forma de la membrana a medida que se dibuja hacia adentro»). El documento describe cómo la jaula en crecimiento debe cambiar su estructura geodésica a medida que se forma la vesícula:
Para doblarse, las redes planas compuestas principalmente de hexágonos deben adquirir pentágonos que requieren reorganizaciones moleculares extensas y eliminación de triskelia.
¿Por qué la célula realizaría esta rutina gimnástica más difícil? El párrafo final ofrece algunas posibles razones:
El reclutamiento de clatrina antes de doblar la membrana proporciona una matriz plana y dinámica como plataforma para el reclutamiento de carga. Esto implica que la membrana a internalizar y el tamaño de la vesícula futura no están determinados por la geometría de la clatrina durante el ensamblaje en una jaula curva, sino que se seleccionan antes de la invaginación durante el reclutamiento de la carga. El intercambio rápido de clatrina es consistente con un enrejado dinámicamente inestable: la inestabilidad dinámica es una propiedad común dentro de las redes de interacciones proteicas de baja afinidad. Permitiría el aborto estocástico de sitios que inician pero no cruzan un punto de control mediado por el crecimiento o la carga antes de invertir energía en la flexión de la membrana. Durante la invaginación, un mayor intercambio permitiría la reorganización de la clatrina y la flexión de la red en una jaula definida que requiere un desmontaje activo.
Una cosa que no se menciona en los artículos es la rapidez de la formación y el desmontaje de las vesículas. Basta decir que la endocitosis y la exocitosis recubiertas de clatrina se producen en las puntas de las células nerviosas, donde las señales eléctricas deben cruzar las sinapsis. Las vesículas se forman en un nervio, cruzan la sinapsis que transportan la carga y son tomadas por la siguiente célula nerviosa en línea. ¿Cuánto tiempo le toma a su cerebro sentir dolor por un dedo gordo? ¡Se formaron muchos CCV, se cruzaron sinapsis y se desmontaron en esa respuesta muy rápida!
¿Evolución o diseño?
Como de costumbre, los artículos y documentos dicen muy poco sobre la evolución. Si se mencionó en absoluto, se trataba de la falta de evolución: por ejemplo, «La proteína arquetípica recubriendo COPI, COPII y clatrina se conservan de la levadura al ser humano«. Solo la pieza de Perspectiva de Noble y Stagg se aventura aún más:
Las proteínas individuales en los tres complejos de proteínas de cubierta diferentes comparten pliegues similares y se propone que sean parientes evolutivos distantes. A pesar de estas similitudes, los recubrimientos han desarrollado diferentes mecanismos funcionales…
Una posibilidad es que la capa proto-COPI haya desarrollado los cuatro enlaces diferentes para expandir el repertorio de geometrías que la capa puede acomodar y, por lo tanto, adaptarse a las necesidades secretoras de la célula.
Estas sugerencias son poco más que afirmaciones posteriores a los hechos de la creencia evolutiva. No se puede invocar un proceso ciego y no dirigido para decir que «evolucionó para» satisfacer las necesidades de la célula. La selección natural darwiniana no tiene previsión.
La complejidad de estas capas y las proteínas accesorias que las construyen, las unen a las vesículas y las desmontan, desafían las explicaciones evolutivas no dirigidas. Exhiben una complejidad irreducible; no funcionan a menos que todas las partes de proteínas estén presentes simultáneamente. Exhiben belleza en la forma en que se organizan en formas geométricas. Las formas, a su vez, están dictadas por códigos digitales en el genoma que producen secuencias que se pliegan en bloques de construcción. Estos bloques de construcción, como el triskelion de la clatrina, no tienen conocimiento de las elegantes cúpulas geodésicas en las que se instalarán. Los triskelia también son ciegos a sus puntos de unión que serán utilizados por otras dos proteínas que desmontarán la vesícula.
Solo vemos destellos de estructuras que aún no entendemos completamente. ¿Por qué se necesitan capas separadas para los tres tipos de transporte? ¿Qué tipos de vesículas necesitan las diferentes capas? ¿Qué ventajas específicas proporcionan los diferentes recubrimientos para el transporte en una dirección y no en la otra? ¿Qué moléculas necesitan vesículas recubiertas opuestas a las vesículas no recubiertas? ¿Qué función proporciona cada proteína en el pelaje?
La investigación adicional a mayor resolución indudablemente generará más conocimiento sobre el transporte vesicular. Una cosa está clara hasta ahora; La elegancia de estos sistemas, su capacidad para remodelar su geometría a medida que crecen, su adaptabilidad a cargas de muchos tamaños, la rapidez de su acción y su conservación de la levadura a los humanos proclaman: «diseño».
Imagen: Izquierda: Una «tríada», bloque de construcción del abrigo COPI. Derecha: vesícula recubierta con COPI hecha de un conjunto de tríadas; por Svetlana Dodonova a través de EMBL.
Artículo publicado originalmente en inglés por Evolution News