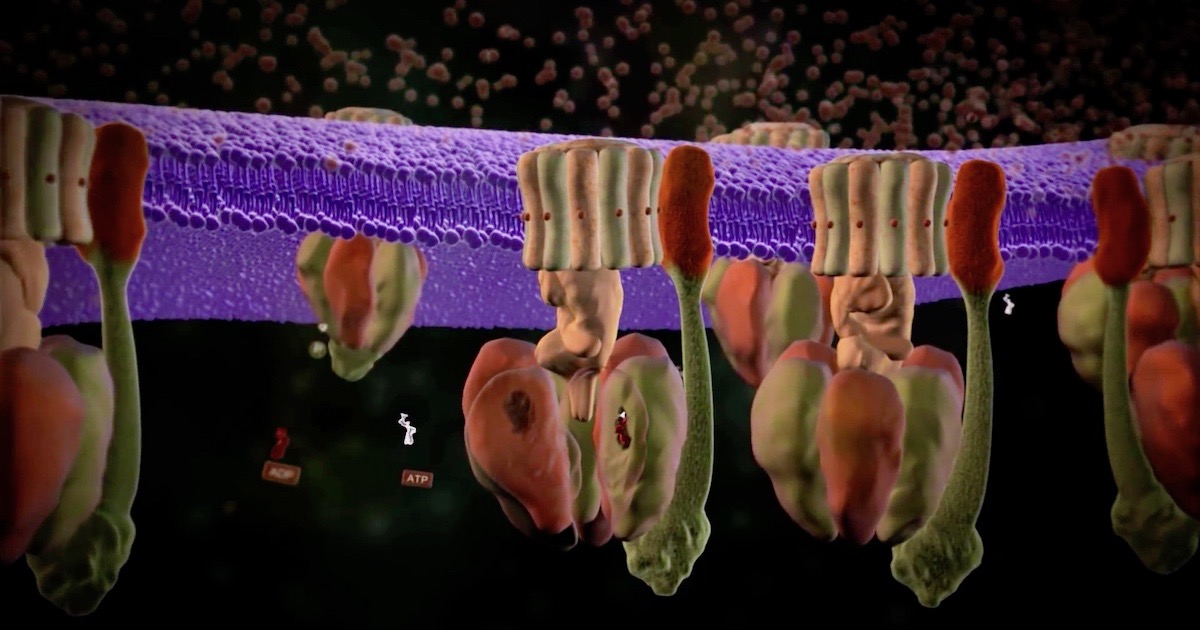
Como dice Michael Behe en su libro Darwin Devolves, el flagelo bacteriano, ese ícono de complejidad irreducible, que nunca se ha explicado por un proceso darwiniano, es uno de los dos motores rotativos que se encuentran en las células. La otra es la ATP sintasa, otro ícono de diseño inteligente. Tres nuevos artículos de este mes encuentran más cosas para admirar. Para una introducción, vea nuestra animación.
Experto en eficiencia
Un artículo en PNAS de Kwangho Nam y Martin Karplus explora “Insights into the origin of the high energy-conversion efficiency of F1-ATPase.” [Perspectivas sobre el origen de la alta eficiencia de conversión de energía de F1-ATPasa]. ¡Y si quieren decir eficiencia!
F1-ATPasa es una pequeña proteína motora, compuesta de 3 subunidades α y 3 β que rodean una subunidad γ central. Las subunidades β alternan cíclicamente entre 2 estados conformacionales principales para producir la rotación de la subunidad γ. Aunque la rotación en la escala de tiempo de microsegundos es impulsada por la unión diferencial de ATP y sus productos de hidrólisis ADP y HPO42−, existe una eficiencia de conversión cercana al 100% de la energía libre de la hidrólisis de ATP, que ocurre en la escala de tiempo de picosegundos. El perfil de energía libre construido para el ciclo de rotación de 360 ° muestra que F1-ATPasa logra su alta eficiencia de conversión de energía al separar elegantemente los eventos catalíticos rápidos, que involucran pequeños cambios conformacionales locales, de la unión / liberación lenta de ligandos involucrados en el gran cambio conformacional. [Énfasis añadido.]
Muchos aprenden en física que la eficiencia del 100 por ciento es inalcanzable en los procesos de conversión de energía. Un motor Carnot teóricamente ideal siempre pierde energía significativa para calentar, y solo puede esperar una eficiencia del 64 por ciento (Penn State). ¿Cómo puede la ATP sintasa lograr una eficiencia cercana al 100%, de modo que la energía de un proceso se convierta completamente a otro, con una pérdida casi nula? El escape térmico es demasiado rápido para superarlo, incluso a esta escala.
Pérdida casi nula
Los autores encontraron una «elegante separación» entre dos eventos catalíticos que operan en escalas de tiempo que difieren en seis órdenes de magnitud. Aparentemente, esto le da al motor tiempo para cambios conformacionales en las partes de proteínas y la liberación de productos que impulsan la rotación del rotor. La elasticidad o «rigidez» en el rotor también contribuye a la conversión eficiente de energía. De modo que cada parte del motor está ajustada con precisión a las demás, la energía libre «cambia linealmente a lo largo de la coordenada de rotación». Esto significa que el motor «funciona cerca de la máxima eficiencia posible».
En los motores con los que estamos familiarizados, como los motores de los automóviles, la eficiencia aumenta con la temperatura. La ATP sintasa, por el contrario, funciona con una pérdida de calor mínima tanto en los peces árticos que viven cerca del punto de congelación como en las bacterias termofílicas que viven en el punto de ebullición. Si los ingenieros humanos pudieran construir motores de automóviles con piezas que se flexionen un poco, en lugar de utilizar pistones y bielas de metal torpes, tal vez verían los aumentos correspondientes en la eficiencia. Pero es dudoso que tales partes puedan funcionar tan rápido o durar tanto como las proteínas en la ATP sintasa.
¿Qué tan rápido?
Una descripción en BioArchitecture afirma: «Las enzimas bacterianas se han cronometrado para funcionar a hasta 42,000 rpm bajo carga baja, aunque para las enzimas intactas en condiciones fisiológicas el número está más cerca de 6000 rpm». Un automóvil típico comienza a alinearse a ese valor. Los autos de carreras de alto rendimiento alcanzan un poco más de 10,000 rpm. ¿No es sorprendente lo que el azar puede hacer?
Las máquinas moleculares, como las ATPasas rotativas descritas aquí, parecen tener mucho en común con las máquinas hechas por el hombre. Sin embargo, las analogías se mantienen solo hasta cierto punto y en gran parte no se comprenden completamente. Lo que es evidente es que varios miles de millones de años de evolución han dado como resultado motores biológicos que son inigualables en eficiencia, afinando su entorno y sostenibilidad. Comprender su función detallada a nivel molecular no solo es importante para satisfacer nuestra curiosidad, sino que sin duda tendrá implicaciones en la comprensión de la fisiología humana, incluidos los trastornos mitocondriales, la bioenergética y los procesos de envejecimiento, así como el impacto en la nanoingeniería y muchos otros campos lejanos.
Equipo flexible
El primer artículo se refería principalmente a la parte F1 de la ATP sintasa, donde se produce la síntesis o hidrólisis de ATP. La parte F0 , donde los protones impulsan la rotación de una rueda tipo carrusel, también contribuye a la eficiencia. Impulsa la subunidad γ que actúa como un árbol de levas. El árbol de levas se extiende hacia la parte F1, en efecto «juntando» ADP y fosfato para formar ATP en tres etapas por revolución: síntesis, eyección y carga. Un artículo de Murphy et al. en Nature explora la flexibilidad en la subunidad γ que contribuye a la eficiencia de esta «máquina bien engrasada».
Los biofísicos se han preguntado durante mucho tiempo acerca de un aparente desajuste entre las partes F0 y F1 del motor. El carrusel F0 se compone generalmente de 8 a 17 subunidades c, dependiendo de la especie, pero el dominio de síntesis F1 tiene seis partes dispuestas en pares. ¿Por qué la relación no entera entre los dominios? La flexibilidad en la subunidad γ se ocupa de algunos de los desajustes almacenando energía elástica, pero parecería un desperdicio durante la rotación continua. Murphy y col. notó que el dominio F1 en realidad toma algo de la holgura al rotarse a sí mismo. El comentario de apertura explica:
Resolvieron estructuras de microscopía crioelectrónica de alta resolución del complejo ATP sintasa, extrayendo 13 subestados rotacionales. Esta colección de estructuras reveló que la rotación del anillo F0 y el tallo central se combina con rotaciones parciales de la cabeza F1. Esta flexibilidad puede permitir que el cabezal combine mejor la rotación continua con eventos discretos de síntesis de ATP.
Una animación en el documento muestra que el dominio F1 experimenta un movimiento de balanceo hacia adelante y hacia atrás a medida que el dominio F0 gira continuamente. El movimiento de balanceo se logra por medio de otra proteína finamente sintonizada llamada OSCP. La belleza de esta solución permite que los cabezales F1 se adapten a diferentes tamaños de rotores F0 a través de una junta universal.
Encontramos que la cabeza F1 gira junto con el tallo central y el anillo c a través de aproximadamente 30 °, o una subunidad c, al comienzo de cada paso de 120 °. El acoplamiento flexible de la cabeza F1 al motor F0 está mediado principalmente por una bisagra en el enlace interdominio de la subunidad de proteína que confiere sensibilidad a la oligomicina (OSCP) que une la cabeza F1 al tallo periférico. El paquete extendido de dos hélices de la subunidad γ del tallo central interactúa con la región del bucle de captura de una subunidad β de la cabeza F1. Es probable que el mecanismo resultante de acoplamiento flexible se conserve en otras F1– F0 ATP sintasas. Nuestros resultados proporcionan un contexto muy necesario para una gran cantidad de datos publicados que indican que OSCP es un centro de control metabólico en la célula.
Los autores concluyen:
En las ATP sintasas, la cabeza catalítica F1 puede acompañar al rotor a través de una rotación de ~ 30 ° al comienzo de cada paso de ~ 120 °. Este movimiento permite un acoplamiento flexible de F1 y F0. La bisagra interdominio de OSCP facilita el acoplamiento flexible y hace de esta subunidad un punto apropiado para la regulación de la síntesis de ATP.
Apropiado significa «adecuado»; bien adaptado; pertinente; pertinente; apto. ”¡Qué acertada una elección de palabras, de hecho!
Donde el ATP va después de la síntesis
Algunas animaciones de la síntesis de ATP muestran los productos que se expulsan de la máquina, como si simplemente volaran por el aire. En realidad, el transporte de ADP dentro y fuera de ATP del motor también está estrictamente regulado. El «portador mitocondrial ADP / ATP» (AAC) está allí, como un camión UPS, para llevar los productos donde se necesitan.
Dentro de la mitocondria, como se informó anteriormente, hay membranas internas y externas, con transportadores TIM y TOM que controlan lo que entra y sale. En otro artículo en Nature, Bertholet et al. descubrió que las proteínas de transporte AAC tienen más que hacer que solo entregar productos. De hecho, ayudan a regular cuántos productos se fabrican. A continuación, recuerde que H + es un protón, el «combustible» en la fuerza motriz del protón que impulsa la rotación F0 en la ATP sintasa. Se supone que los protones permanecen en la membrana mitocondrial interna, pero al ser pequeños, pueden «filtrarse». ¿Puede esa fuga servir un propósito? Esté atento al conductor del camión AAC:
Aquí registramos las corrientes AAC directamente de las membranas mitocondriales internas de varios tejidos de ratones e identificamos dos modos de transporte distintos: intercambio ADP / ATP y transporte H +. La corriente de H + mediada por AAC requiere ácidos grasos libres y se asemeja a la fuga de H + a través de la proteína termogénica de desacoplamiento 1 que se encuentra en la grasa marrón. El intercambio ADP / ATP a través de AAC regula negativamente la fuga de H +, pero no la inhibe por completo. Esto sugiere que la fuga de H + y el desacoplamiento mitocondrial podrían controlarse dinámicamente por la demanda de ATP celular y la tasa de intercambio de ADP / ATP. Al mediar dos modos de transporte distintos, el intercambio de ADP / ATP y la fuga de H +, AAC conecta la conversión de energía acoplada (producción del ATP) y desacoplada (termogénesis) en las mitocondrias.
Traduciendo esto a una analogía más cotidiana, el conductor del camión AAC vigila cuántos protones se están filtrando al citoplasma y llama a la casa del motor para que reduzcan la producción. Cuando el conductor del camión puede mantenerse al día con la producción, la fuga de protones es pequeña (regulación negativa). Pero cuando se escapan más protones, el controlador advierte que la ATP sintasa está superando la demanda.
Más complicado, como de costumbre
En realidad es más complicado que esto, como siempre. La fuga de protones (IH) está controlada por otra proteína, la proteína de desacoplamiento n. ° 1 (UCP1), que regula los protones que cruzan la membrana mitocondrial interna. Esta proteína funciona en asociación con AAC, que está haciendo su trabajo entregando ATP al citosol o trayendo ADP nuevamente. El resultado es otra solución “maestra” para regular “delicadamente” la cantidad de producción de ATP.
Con AAC, IH está regulado negativamente por el intercambio ADP / ATP, mientras que con UCP1, IH es simplemente inhibido por nucleótidos de adenina citosólicos. Esta capacidad de ajustar dinámicamente la IH de acuerdo con el intercambio ADP / ATP (y, por lo tanto, la demanda celular de ATP) podría hacer que AAC sea especialmente adecuado para ser el UCP de las mitocondrias que se especializan en la producción de ATP. Por lo tanto, AAC parece servir como un regulador maestro de la producción de energía mitocondrial, manteniendo un delicado equilibrio entre la producción de ATP y la termogénesis.
Más detalles, más precisión
A medida que salen a la luz más detalles de la ATP sintasa, aparece cada vez más ajustes. La síntesis de ATP, necesaria desde el comienzo de la vida metabólica, ahora se ve fenomenalmente eficiente y magistralmente regulada por múltiples partes que trabajan juntas. Solo da la oportunidad de miles de millones de años, y milagros como este pueden suceder. ¿No?
Imagen: Una escena de «ATP Synthase: The Power Plant of the Cell», a través de Discovery Institute.
Artículo publicado originalmente en inglés por Evolution News