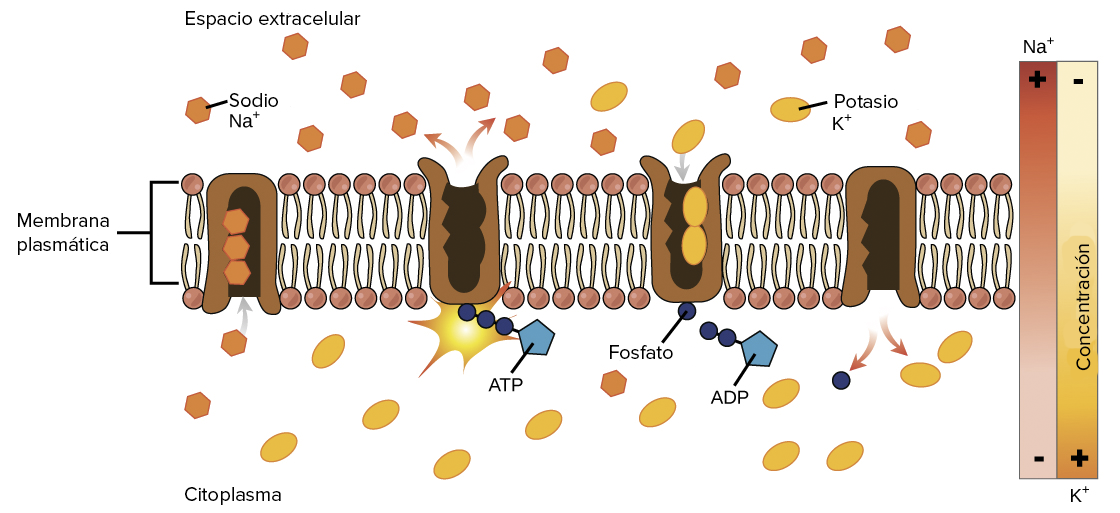
Una diferencia clave entre la vida y lo inerte es el transporte activo. A diferencia de la ósmosis o difusión natural, que tiende a mover las moléculas de áreas de alta concentración a áreas de baja concentración, el transporte activo se logra a través de máquinas moleculares capaces de reconocer y permitir selectivamente el paso, incluso contra un fuerte gradiente de concentración. Al igual que el demonio de Maxwell, los canales de la membrana celular parecen violar las leyes de la física. No se violan las leyes, por supuesto, como tampoco los torniquetes en Disney World violan la física para impedir que la gente no compre un boleto. En ambos casos, es la programación y la colocación de partes específicas lo que permite que los mecanismos vayan en contra de lo que ocurriría por la naturaleza no determinada.
La mejora de la calidad de las técnicas de imagen está permitiendo a los científicos profundizar en los mecanismos de los canales de la membrana celular. Diferentes canales funcionan de diferentes maneras. Todos tienen algún tipo de «filtro de selectividad» para permitir el paso de las moléculas deseadas y excluir otras. Aquí hay algunos descubrimientos nuevos.
El gran canal de potasio
Los biofísicos de la Universidad de Massachusetts en Amherst han descubierto el filtro de selectividad de un tipo de canal iónico, el canal de «gran potasio» (GP). Este canal opera muy rápidamente en las células musculares y nerviosas. Las cadenas de estos canales en la membrana celular se «disparan» en rápida sucesión, creando una ola de información que puede pasar de un dedo al cerebro tocado en una fracción de segundo. Los científicos esperaban que este canal operara algún tipo de puerta que se abriera y cerrara, como en otros tipos de canales. Pero antes de ahora, estaban desconcertados acerca del por qué el gran poro central del canal parecía permanecer abierto, incluso cuando los átomos de potasio no estaban entrando.
Este rompecabezas llevó al equipo de la UMass a descubrir un mecanismo completamente nuevo que denominan «deshidratación hidrofóbica», que es «drásticamente diferente de lo que se ha observado en otros canales iónicos». Un cambio en la unión del calcio en el canal hace que las moléculas de agua se formen a como sucede sobre una superficie aceitosa. «Cuando el poro GP es aceitoso, el agua forma una fase de vapor que actúa como una barrera e impide que entren todos los iones», dice Jianhan Chen, un miembro del equipo que resolvió el rompecabezas, utilizando un modelo computacional probado contra estudios mutagénesis del mundo real.
Él dice: «Si piensas por qué la naturaleza podría querer usar una barrera de vapor donde hay un gran poro que tiene que transportar mucha corriente eléctrica, para aplicar una barrera física necesitarías una reorganización estructural de proteínas que probablemente sea demasiado grande o demasiado lento, o ambos. En cierto modo, la naturaleza es realmente inteligente en el uso de este fenómeno hidrofóbico de deshidratación para crear una puerta sensible y rápida. Realmente nos sorprendimos al ver que los cambios en la forma de los poros y las propiedades de la superficie son relativamente pequeños y sutiles, pero tienen grandes consecuencias en sus propiedades de hidratación «. [Énfasis añadido]
El documento de investigación de acceso abierto, en Nature Communications, expresa sorpresa por este mecanismo único pero muy eficaz:
El mecanismo de activación de los canales iónicos transmembranales es crucial para comprender cómo estas proteínas controlan el flujo de iones a través de las membranas en diversos procesos fisiológicos. Los canales grande de potasio (GP) son particularmente interesantes con una conductancia de un solo canal grande y regulación dual por voltaje de membrana y Ca2+ intracelular. Las estructuras atomísticas recientes de los canales GP no pudieron identificar las características estructurales que podrían bloquear físicamente el flujo de iones en el estado cerrado. Aquí, mostramos que la activación de canales GP no parece requerir una puerta física. En cambio, los cambios en la forma de los poros y la hidrofobicidad de la superficie en el estado libre de Ca2+ permiten que el canal sufra fácilmente transiciones de despulpado hidrófobas, dando lugar a una gran barrera de energía libre para la permeación de K+.
El canal de protones dependiente de voltaje
Otro canal de iones llamado HV1, vital para la salud de todo, desde los tunicados del mar hasta los humanos, es capaz de discriminar protones. «La apertura de HV1 es evidentemente más complicada de lo que imaginábamos«, concluye Thomas E. DeCoursey en una revisión de investigación en los Proceedings of the National Academy of Sciences (PNAS). Discute los hallazgos recientes de dos estudios sobre HV1 que parecen indicar que se producen cambios conformacionales coordinados entre subunidades en el filtro de selectividad antes de que pueda pasar un protón. Esta «compuerta cooperativa» sugiere que «cada canal debe experimentar múltiples transiciones dependientes de voltaje entre estados cerrados antes de que se abra«. No debería sorprender que un canal capaz de controlar el paso de iones de hidrógeno atómicamente pequeños debe operar con la mayor precisión y cuidado. Por cierto, DeCoursey señala que una sola célula de eosinófilos en el torrente sanguíneo tiene hasta 40,000 de estos canales HV1.
El Uniportador Mitocondrial
Este canal, que se encuentra en las membranas mitocondriales, debe discriminar entre el calcio (Ca) y el manganeso (Mn), que son solo 5 números atómicos en la tabla periódica. Si el uniportador no logra discriminar entre sus iones de doble carga (Ca2+ y Mn2+) puede provocar una «toxicidad por manganeso» que está implicada en discapacidades neurodegenerativas como la enfermedad de Parkinson.
Ca2+ activa la «maquinaria del uniportador», dice un equipo de siete miembros principalmente del Instituto Médico Howard Hughes y Harvard, informando en PNAS. Observe la complejidad irreducible requerida para otorgar a este importante canal de transporte su exquisita selectividad y capacidad para resistir un gradiente de concentración pronunciado de iones no deseados:
El uniportador mitocondrial es un canal de Ca2+ activado por Ca2+ en la membrana interna del orgánulo. Presenta una conductancia notablemente alta y una selectividad de iones alta. Es capaz de discriminar entre Ca2+ y otros cationes, incluso aquellos que son de tres a seis órdenes de magnitud más abundantes, como K+ o Mg2+. Típicamente, la selectividad iónica de la conductancia en los canales de Ca2+ es proporcionada por el filtro de selectividad, un pasaje estrecho en el poro del canal que contiene aminoácidos acídicos preparados para quelar el ión conducido. Esta forma de selectividad del uniportador es conferida por un motivo «DXXE» altamente conservado ubicado en el vértice intermembranal del espacio del poro. Sin embargo, para el uniportador mitocondrial, el calcio no solo es el ión transportado, sino que también actúa como un ligando regulador involucrando las manos EF de la subunidad reguladora MICU1 del uniportador. En principio, y como demostramos en este documento, la selectividad de iones en el sitio de activación del ligando puede contribuir significativamente a la selectividad de iones global del complejo del canal.
Este canal debe permitir una rápida conductancia del calcio, pero resistir el manganeso. ¿Cómo lo hace? «Concluimos que la notable capacidad del uniportador para discriminar entre Ca2+ y Mn2+ reside, en parte, en el complejo regulador MICU1-MICU2«.
Los experimentos en el laboratorio del gusano redondo C. elegans mostraron que el regulador MICU1 puede unirse a cualquiera de los iones, pero solo el ión calcio desencadena un cambio conformacional. Actúa como un punto de control, por lo tanto, para asegurar que el manganeso no pase:
En el estudio actual, hemos demostrado que MICU1 proporciona un punto de control que permite al complejo uniportador mitocondrial discriminar entre Ca2+ y Mn2+. Cuando MICU1 está ausente, tanto Mn2+ como Ca2+ pueden pasar libremente a través del uniportador porque la conductancia no es muy selectiva para Ca2+ sobre Mn2+ y se pierde la selectividad de activación del uniportador. En el complejo holo, el transporte de Mn2+ se bloquea a menos que Ca2+ se interactúe con las manos EF de MICU1 para inducir una transición conformacional específica.
Conclusión
Esto fue solo una breve mirada a tres mecanismos diferentes en tres canales diferentes que facilitan el transporte activo. Hay docenas de familias de canales, que ofrecen colectivamente cientos de máquinas moleculares diferentes vitales para la vida.
Una célula que no puede controlar lo que entra o sale de su interior no puede sobrevivir. La ciencia debe rechazar todas las hipótesis poco realistas que representan bolsas simples de moléculas que intentan convertirse en células. Oparin lo intentó en la década de 1920, y algunos intentan mantener vivo su sueño (Astrobiology Magazine). Si la célula más fácil de concebir requiere canales tan complejos como estos, ¿qué se puede esperar de los otros requisitos, como un código genético, metabolismo y una membrana? Claramente, tales mecanismos complejos, todos trabajando juntos en armonía, están muy lejos del alcance de la casualidad. Las “totalidades funcionales” coordinadas y ordenadas jerárquicamente, como las denomina Douglas Ax en su libro Undeniable, son características del diseño inteligente.
Créditos de la imagen: Khan Academy