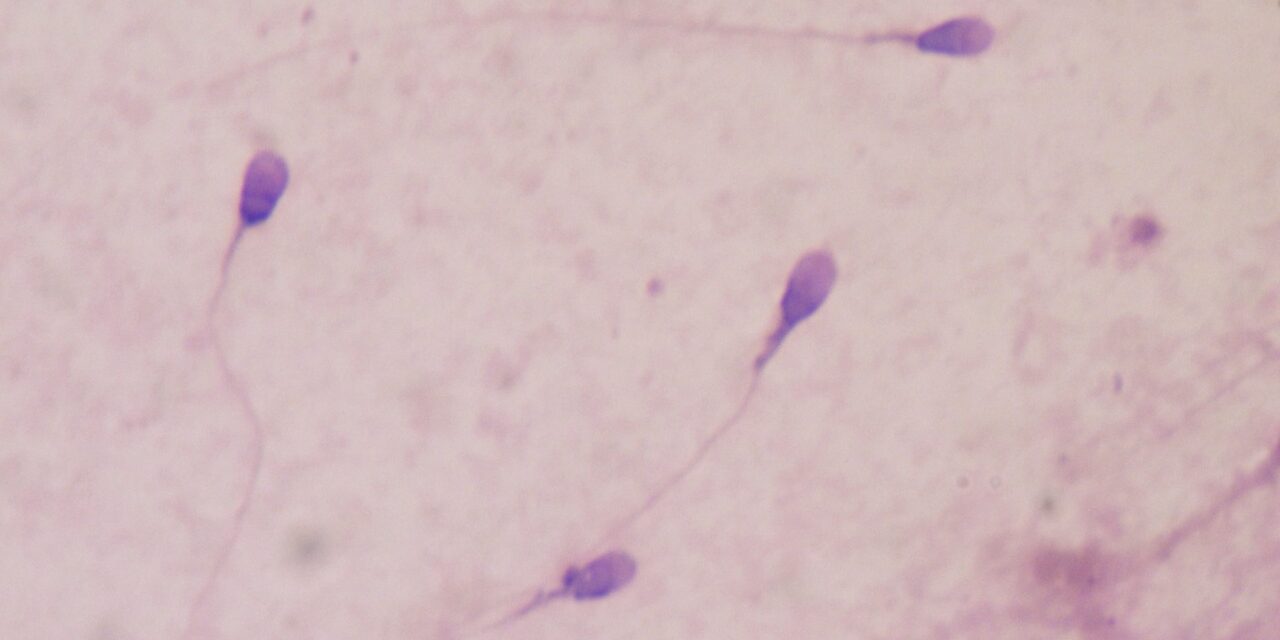
La reproducción humana es quizás el ejemplo por excelencia de la teleología en biología. El proceso mediante el cual un óvulo fertilizado se convierte en un bebé en el espacio de nueve meses revela una ingeniería exquisita y un diseño ingenioso. Antes de que este intrincado proceso pueda siquiera comenzar, es necesario que un espermatozoide se fusione con un óvulo; cada uno de ellos lleva, en el caso de los humanos, 23 cromosomas. Esta increíble hazaña lleva el sello inconfundible de una intención y previsión conscientes. Puedes ver una animación de este notable proceso aquí:
Aquí me centraré en las características de diseño de los espermatozoides. En una publicación posterior, discutiré las características de diseño del líquido seminal y la capacitación de los espermatozoides. Los espermatozoides se componen de tres componentes: la cabeza, la pieza media y el flagelo, y cientos de millones de ellos se transportan en el líquido seminal que se libera en el cuello uterino a través de la eyaculación durante las relaciones sexuales. Con cada eyaculación, el macho libera entre doscientos y quinientos millones de espermatozoides (aproximadamente 100 millones por mililitro de semen). Cada uno de estos tres componentes, y el líquido seminal, es crucial para la misión del espermatozoide de fusionarse con un óvulo para formar un cigoto (un óvulo fertilizado). Consideremos cada uno por separado.
La cabeza
La cabeza lleva fibras de cromatina densamente enrolladas que contienen el genoma haploide, lo que representa la mitad del material genético que heredará la próxima generación (la otra mitad provendrá del óvulo de la madre). El embalaje hermético del ADN sirve para minimizar su volumen para el transporte.
En la punta de la cabeza del espermatozoide hay un orgánulo membranoso, llamado acrosoma, que contiene varias enzimas hidrolíticas. Cuando se secretan, digieren la membrana del óvulo, facilitando así la penetración del óvulo. Sin el acrosoma, el espermatozoide no podrá penetrar la membrana del óvulo para fertilizar el óvulo. Según un artículo de revisión publicado en Frontiers in Cell and Developmental Biology:
Cualquier anomalía acrosómica estructural o funcional podría afectar la fusión de los espermatozoides y, en última instancia, provocar infertilidad. Además, los estudios han demostrado que la inseminación intracitoplasmática con espermatozoides que contienen anomalías acrosómicas no condujo a una fertilización exitosa, incluso en ausencia de barreras de fertilización, porque el ovocito no pudo activarse eficientemente… Por lo tanto, el acrosoma es indispensable para la fertilización.1
Cuando un espermatozoide llega a las proximidades del óvulo, sufre una serie de interacciones moleculares con la zona pelúcida, que es una matriz extracelular especializada que rodea el óvulo. Los receptores específicos de la membrana plasmática del espermatozoide, como las espermadhesinas o las integrinas, reconocen y se unen a los ligandos correspondientes de la zona pelúcida. Esta unión desencadena la activación de vías de señalización en los espermatozoides. La unión de los receptores espermáticos a los ligandos de la zona pelúcida provoca una entrada de iones calcio (Ca2+) al espermatozoide. Esta entrada de calcio suele estar mediada por canales iónicos o receptores en la membrana plasmática del espermatozoide, que se activan tras la unión del ligando-receptor. El aumento de los niveles de calcio intracelular inicia una cascada de señales dentro del espermatozoide. Los iones de calcio actúan como segundos mensajeros y desencadenan la activación de varias moléculas de señalización y enzimas, incluidas las proteínas quinasas. Como resultado de la cascada de señalización mediada por calcio, el acrosoma sufre exocitosis. La membrana que rodea el acrosoma se fusiona con la membrana plasmática del espermatozoide, provocando la liberación del contenido acrosómico, incluidas enzimas como la hialuronidasa y la acrosina. Las enzimas liberadas por el acrosoma ayudan a degradar la matriz glicoproteica de la zona pelúcida, permitiendo que los espermatozoides penetren y alcancen la membrana plasmática del óvulo. El contenido acrosómico ayuda a la ruptura de las capas protectoras que rodean al óvulo, facilitando la fusión de los espermatozoides y las membranas del óvulo.
La formación del acrosoma se divide en cuatro etapas. La primera etapa, la «fase de Golgi», depende del aparato de Golgi, que produce y empaqueta las proteínas y enzimas necesarias para la formación de acrosomas. Luego, estas proteínas se transportan a la vesícula acrosómica en desarrollo. En la segunda fase, la “fase de tapa”, la vesícula derivada de Golgi (conocida como vesícula proacrosomal) se fusiona con la porción anterior del núcleo, formando una estructura similar a una tapa sobre el núcleo. La fusión de la vesícula con el núcleo está mediada por procesos de tráfico de membranas. La vesícula proacrosomal contiene enzimas, glicoproteínas y otros componentes que son esenciales para la maduración del acrosoma. En la tercera fase, la «fase acrosómica», la estructura en forma de casquete sufre una serie de cambios estructurales que conducen a la formación del acrosoma. La vesícula proacrosomal se aplana y se alarga, extendiéndose por la región anterior del núcleo. Las enzimas derivadas de Golgi modifican las proteínas presentes en la vesícula proacrosomal, convirtiéndolas en sus formas activas. La membrana acrosómica también sufre cambios, especializándose para las funciones del acrosoma. En la fase final, la «fase de maduración», el acrosoma sufre más modificaciones y maduración. Las enzimas dentro del acrosoma se activan completamente y la matriz acrosómica sufre cambios, volviéndose más condensada. El gránulo acrosómico, que es la región central del acrosoma, se vuelve muy denso en electrones debido a la acumulación de enzimas y proteínas. El acrosoma maduro ahora está listo para desempeñar su papel en la fertilización. Para obtener una descripción más detallada de este increíble proceso, remito a los lectores a un artículo de revisión sobre el “Mechanism of Acrosome Biogenesis in Mammals.” [Mecanismo de biogénesis acrosómica en mamíferos].2
La pieza media
La pieza intermedia consta de un núcleo filamentoso central, alrededor del cual hay muchas mitocondrias ubicadas estratégicamente que sintetizan la molécula energética trifosfato de adenosina (ATP). La complejidad y el diseño de la generación de energía dentro de las mitocondrias, incluidos los procesos de glucólisis, el ciclo del ácido cítrico (o de Krebs), la cadena de transporte de electrones y la fosforilación oxidativa, podrían ocupar su propia serie de artículos, pero este es un tema para otro día. Para una buena introducción a los fenomenales procesos dentro de las mitocondrias, aquí hay tres animaciones de la Universidad de Harvard que dan vida a este fascinante orgánulo:
El ATP generado por las mitocondrias energiza los golpes de energía del flagelo, impulsando su viaje a través del cuello uterino femenino, el útero y las trompas uterinas. Como tal, la pieza intermedia del espermatozoide es absolutamente esencial para su función de nadar a través del útero femenino y las trompas de Falopio para fertilizar su óvulo. Sin la pieza intermedia y sus mitocondrias, los espermatozoides están completamente inmóviles.
El flagelo
A diferencia del flagelo bacteriano (que gira como un motor), el flagelo del espermatozoide late con un movimiento similar al de un látigo para producir motilidad. ¿Cómo funciona el flagelo? En 2018, Jianfeng Lin y Daniela Nicastro dilucidaron el mecanismo de la motilidad flagelar.3 Sus datos indicaron que “la flexión se generó por la distribución asimétrica de la actividad de la dineína en lados opuestos del flagelo”4 (las dineínas son motores moleculares impulsados por ATP que “caminan hacia abajo”). ”a lo largo de los microtúbulos hacia su extremo negativo). Sus resultados también revelaron que la flexión flagelar alterna se produce debido a «un mecanismo de ‘inhibición de interruptor’ en el que se genera un desequilibrio de fuerza al inhibir… las dineínas en los lados alternos del flagelo».5 En otras palabras, las señales reguladoras conducen a la inhibición de motores dineídicos en un lado del flagelo. Mientras tanto, del otro lado, las dineínas caminan a lo largo de los microtúbulos. El flagelo se dobla en una dirección debido a enlaces moleculares que resisten este deslizamiento. La flexión flagelar se alterna cambiando repetidamente el lado de la inhibición de la dineína.
No hace falta decir que, sin el flagelo, el espermatozoide está completamente inmóvil y no tiene posibilidades de fertilizar el óvulo.
Hasta ahora hemos considerado la complejidad irreductible de los componentes de un espermatozoide. En un artículo posterior, consideraremos las características de diseño del líquido seminal y el proceso de capacitación de los espermatozoides que tiene lugar dentro del tracto reproductivo femenino.
Notas
- Khawar MB, Gao H, Li W. Mechanism of Acrosome Biogenesis in Mammals. Front Cell Dev Biol. 2019 Sep 18;7:195.
- Ibid.
- Lin J, Nicastro D. Asymmetric distribution and spatial switching of dynein activity generates ciliary motility. Science. 2018 Apr 27;360(6387):eaar1968.
- Ibid.
- Ibid.
Artículo publicado originalmente en inglés por Jonathan McLatchie Ph.D. en Evolution News & Science Today